T-Zellen (Repertoire und Antigene)
Warum untersuchen wir die T-Zellen? Wir sind umgeben von einer Vielzahl von Pathogenen, wie Bakterien, Pilzen, Viren, Würmern und anderen Parasiten, die alle gern teilhaben möchten an unserem Innenleben, wo es nicht nur warm und feucht ist, sondern es auch noch viele Nährstoffe gibt. Von den wenigen Pathogenen, die es schaffen, die Barrieren wie Haut und Schleimhäute zu überwinden, werden 95 % durch die Zellen des angeborenen Immunsystems eliminiert. Um die restlichen 5 % der Eindringlinge zu bekämpfen, werden die T-Zellen gebraucht. Um gegen alle gewappnet zu sein, ist nicht jede T-Zelle wie die andere, sondern jede T-Zelle hat ihren eigenen Rezeptor. Es gibt 1.000 Billionen (1015) verschiedene Rezeptoren für T-Zellen, sodass unter allen T-Zellen eines Individuums auf jeden Fall eine ist, die den Eindringling (Antigen) erkennen kann. Wenn eine T-Zelle ihr Antigen getroffen hat, wird sie aktiviert und beginnt sich massiv zu teilen. (Abbildung 1)
Die Gesamtheit der T-Zell-Rezeptoren und die Anzahl der T-Zellen eines Individuums nennt man das T-Zell-Repertoire. Es ändert sich im Laufe des Lebens: Die Diversität des T-Zell-Repertoires ist in jungen Jahren am höchsten, wenn der Thymus kontinuierlich neue T-Zellen produziert, und wird geringer im Alter durch die Zurückbildung des Thymus, die zunehmende homöostatischen Proliferation und durch die Bildung von Gedächtnis-T-Zellen. Es wird angenommen, dass ein hochdiverses T-Zell-Repertoire eine wichtige Voraussetzung ist, um eine gegen Erreger gerichtete T-Zell-Antwort schnell und erfolgreich zu beenden, um einen Impfschutz aufzubauen oder auch um vor Autoimmun- und Allergieerkrankungen geschützt zu sein. In unserer Arbeitsgruppe beschäftigen wir uns daher mit der Diversität des T-Zell-Repertoires vor, während und nach dem Verlauf verschiedener T-Zell-Antworten. Dabei fokussieren wir besonders auf die antigenspezifischen T-Zellen, die follikulären CD4+-T-Helfer-Zellen, die während B-Zell-vermittelter T-Zell-Antworten in die Keimzentren wandern. In den Keimzentren helfen sie, die dort ablaufende Immunantwort durch B-Zellen zu verbessern. Dies führt zu noch passgenaueren Antikörpern gegen Eindringlinge.
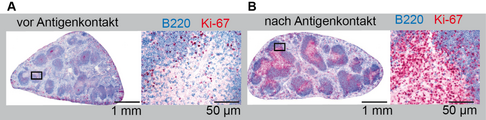
Um follikuläre CD4+-T-Helfer-Zellen zu gewinnen, werden durch die Injektion verschiedener Antigene Keimzentren in den lymphatischen Organen induziert. Die follikulären T-Helfer-Zellen können dann entweder über Zell-spezifische Marker (z. B. CD4+/CXCR5+) von den anderen Zellen getrennt werden oder mit dem Laser-Mikrodissektions-Mikroskop aus einem histologischen Schnitt herauskatapultiert werden. Dafür werden zuerst die Keimzentren in immunhistochemischen Färbungen sichtbar gemacht. Die T-Zellen, die in der hellen Zone der Keimzentren akkumulieren, sind die follikulären CD4+-T-Helfer-Zellen. Nachdem die follikulären CD4+-T-Helfer-Zellen isoliert wurden, werden die Sequenzen aller T-Zell-Rezeptoren mit der Hochdurchsatzmethode der Next-Generation-Sequenzierung bestimmt. Durch die Injektion verschiedener Antigene, wie z. B. Peptiden mit Adjuvantien, Autoantigenen, hochkomplexen Antigenen, Impfstoffen und Proteingemischen unter unterschiedlichen Bedingungen können T-Zell-Antworten hochspezifisch verfolgt werden. Neben den follikulären T-Helfer-Zellen werden auch zirkulierende T-Zellen im Blut von Patienten untersucht, um Infektionsverläufe, Impferfolge oder den Verlauf von Autoimmunerkrankungen, Chemotherapien oder Knochenmarkstransplantationen zu verfolgen. Ziel ist es dabei, krankheitsrelevante T-Zell-Sequenzen zu identifizieren und in zukünftigen Therapieansätzen zu beeinflussen.
Unsere Arbeitsgruppe ist gut vernetzt mit anderen Forschungsgruppen der Universität zu Lübeck und dem UKSH Campus Lübeck. So gibt es enge Kooperationen mit der Klinik für Dermatologie, der Klinik für Rheumatologie und dem Institut für systemische Entzündungsforschung. Mit diesen Einrichtungen verbindet uns die gemeinsame Ausbildung von PhD-Studierenden im Rahmen des Graduiertenkollegs 2633.


- Forschung
- Profil
- Arbeitsgruppen
- Barriere-Organe
- T-Zellen (Migration und Memory )
- T-Zellen (Repertoire und Antigene)
- Elektronenmikroskopie
- Klinische Anatomie
- Publikationen
Projektleiter
Kathrin Kalies

Biochemikerin / Privatdozentin
Gebäude 63
,
Raum 113
kathrin.kalies(at)uni-luebeck.de
04513101-7130
Farbod Bahreini

Doktorand
Gebäude 63
,
Raum 108
farbod.bahreini(at)uni-luebeck.de
04513101-7135
Daniela Rieck

MTLA
Gebäude 63
,
Raum 7
daniela.rieck(at)uni-luebeck.de
04513101-7133
